프러시안 블루
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
프러시안 블루는 짙은 파란색을 띠는 착체로, 1706년경 독일에서 처음 합성된 안정적인 파란색 안료이다. 이집트 파랑의 기술이 사라진 후 널리 사용되었으며, 울트라마린의 대체재로 사용되어 회화, 염색 등에 널리 사용되었다. 화학적으로는 페로시안화철의 일종으로, 시안화물 염의 산화로 생성되며, 18세기부터 프로이센 군복의 색으로 사용되기도 했다. 의학적으로는 탈륨이나 세슘 중독 치료에 사용되며, 조직 병리학 염색 및 엔지니어 블루 등 다양한 용도로 활용된다. 그러나 프러시안 블루는 열이나 알칼리에 약하고, 미세 입자 흡입 시 폐 질환을 유발할 수 있으며, 방사성 세슘과 결합하여 위험성을 증가시킬 수 있어 취급에 주의가 필요하다.
더 읽어볼만한 페이지
- 사이안화물 - 치클론 B
치클론 B는 시안화수소를 주성분으로 하는 살충제로, 2차 세계 대전 중 나치 독일의 절멸 수용소에서 유대인 학살에 사용되어 악명이 높으며, 현재는 대부분의 국가에서 사용이 금지 또는 제한되었다. - 사이안화물 - 사이안화 수소
사이안화 수소(HCN)는 탄소와 질소의 삼중 결합을 가진 가연성 기체 화합물로, 산업적으로 대량 생산되어 다양한 용도로 사용되지만 인체에 매우 유독하여 세포 호흡을 방해할 수 있다. - 해독제 - 아세틸시스테인
아세틸시스테인(NAC)은 점액 용해 작용을 하는 약물로, 파라세타몰 해독, 호흡기 질환 치료, 간 보호, 항균 효과가 있으며, 일부 부작용과 고용량 투여 시 위험이 존재하고, 현재 다양한 질환에 대한 치료 효과 연구가 진행 중이다. - 해독제 - 디메르카프롤
디메르카프롤은 중금속 중독 치료에 사용되는 킬레이트제로, 금속 이온과 결합하여 중금속의 작용을 억제하고 체외 배출을 돕지만 자체 독성과 부작용으로 사용이 제한적이며 특정 중금속 중독에는 금지된다. - 청색조 - 남색
남색은 다양한 식물에서 추출하는 파란색 염료를 지칭하며, 고대부터 여러 지역에서 사용되었고, 현대에는 색상 정의와 사용 분야에 차이가 있다. - 청색조 - 로열 블루
로열 블루는 진하고 선명한 파란색을 지칭하는 색 이름으로, 시대와 지역에 따라 색상에 대한 인식이 다소 다르며, 웹 색상으로 지정된 더 밝은 색상도 존재하고, 다양한 문화적 의미를 지니며 여러 국가의 깃발이나 스포츠 팀의 유니폼 색상으로 활용된다.
2. 역사
프러시안 블루는 1704년 베를린에서 연금술사 요한 디펠의 지도하에 안료 제조를 하던 요한 디스바흐에 의해 우연히 발견되었다(디펠-디스바흐법).[71] 당시 유럽에서는 비교적 저렴한 청색 안료 "애주라이트"가 이탈리아·베네치아를 통해 수입되었지만, 이탈리아보다 북쪽인 독일 등의 나라에는 닿지 않아 곤청은 고가인 아프가니스탄산 청금석제 안료 "울트라마린"(페르메이르나 렘브란트 시대까지 주요 안료였다)을 빠르게 대체하고, 도자기 채색에도 널리 사용되었다. 이후 파리에서도 제조되었지만, 제조 방법은 비밀로 여겨졌다.
1731년, 게오르크 에른스트 슈탈은 프러시안 블루의 첫 합성에 대한 보고서를 발표했다.[12] 이 보고서는 디스바흐와 요한 콘라드 디펠이 관련된 내용을 담고 있다. 디스바흐는 코치닐에서 붉은 레이크 안료를 만들려 했지만, 오염된 잿물을 사용한 결과 파란색 안료를 얻게 되었다. 그는 디펠이 동물성 오일 생산에 사용했던 잿물을 빌렸는데, 다른 역사적 출처에서는 디펠을 언급하지 않아 이 이야기의 신뢰성은 판단하기 어렵다.
1752년, 프랑스 화학자 피에르 J. 마케는 프러시안 블루를 철의 염과 새로운 산으로 환원시킬 수 있으며, 이 산을 사용하여 염료를 재구성할 수 있다는 중요한 사실을 발견했다.[16] 1782년, 스웨덴 화학자 칼 빌헬름 셸레는 프러시안 블루에서 새로운 산을 순수한 형태로 분리하고 특성화했는데, 이 산은 프러시안 블루에서 파생되었다는 이유로 Blausäurede (문자 그대로 "파란 산")라는 이름이 붙었으며, 영어로는 청산이라고 알려지게 되었다.[17] 프러시안 블루 생성 과정에서 나오는 무색 음이온인 시안은 어두운 파란색을 의미하는 그리스어에서 유래했다.
1800년대 후반, 랍비 게르숀 헤노흐 라이너는 하시디즘 라진의 레베로서, 세피아로 만든 프러시안 블루로 치치트를 염색하여 이것이 진정한 테켈레트 염료라고 믿었다. 그러나 인공 염료라는 점 때문에 일부는 이것이 테켈레트인지 의문을 제기했고, 랍비 라이너가 이 사실을 알았다면 입장을 철회했을 것이라고 주장했지만,[18] 다른 사람들은 이에 반박하며 랍비 라이너는 철회하지 않았을 것이라고 주장했다.[19]
2. 1. 발견과 초기 발전
프러시안 블루는 이집트 파랑의 합성에 대한 지식이 사라진 이후 널리 사용된 최초의 안정적이고 비교적 내광성이 있는 파란색 안료라는 점에서 중요하다. 유럽 화가들은 이전에 인디고 염료, 스몰트, 타이어 자색, 그리고 매우 비싼 울트라마린과 같은 여러 안료를 사용했다. 일본 화가와 목판화 예술가들 또한 유럽에서 프러시안 블루를 수입하기 전까지 오래 지속되는 파란색 안료를 사용할 수 없었다.[3]프러시안 블루는 1706년경 베를린의 화가 요한 야콥 디스바흐에 의해 처음으로 합성되었을 것으로 추정된다.[4][5] 디스바흐가 붉은 코치닐 염료를 만들기 위해 잿물에 혈액이 섞인 것을 사용했을 때 우연히 만들어진 것으로 보인다. 원래의 염료는 잿물, 염화철, 그리고 건조된 코치닐이 필요했다. 하지만, 혈액, 잿물, 그리고 황산철이 반응하여 원하던 붉은색 안료와는 달리 매우 뚜렷한 파란색을 띠는 페로시안화철이라는 화합물을 만들었다.[6] 1709년에 이 안료를 처음 거래한 사람이 Preußisch blaude(Preußisch blau|프로이시슈 블라우de)와 Berlinisch Blaude(Berlinisch Blau|베를리니슈 블라우de)라고 명명했다.[7][8][9]
이 안료는 비싼 라피스 라줄리에서 추출한 울트라마린을 쉽게 대체했으며, 1708년과 1716년 사이에 요한 레온하르트 프리쉬와 프로이센 과학 아카데미 회장 고트프리트 빌헬름 라이프니츠 사이에서 오간 편지에서 중요한 주제였다.[7] 1708년 3월 31일, 프리쉬가 라이프니츠에게 보낸 편지에 처음 언급되었다. 늦어도 1708년까지 프리쉬는 유럽 전역에서 이 안료를 홍보하고 판매하기 시작했다. 1709년 8월까지 이 안료는 Preussisch blaude라는 이름으로 불렸고, 1709년 11월까지 프리쉬에 의해 독일어 이름 Berlinisch Blaude가 처음 사용되었다. 프리쉬는 1710년 논문 Notitia Coerulei Berolinensis nuper inventila(Notitia Coerulei Berolinensis nuper inventi|최근 발견된 베를린 블루에 대한 보고la)에 프러시안 블루에 대한 최초의 간행물을 낸 저자이기도 하다. 이는 그의 편지에서 추론할 수 있다. 디스바흐는 1701년경부터 프리쉬를 위해 일했다.

현재까지, 피터 판 데어 베르프의 1709년 작품인 ''그리스도의 매장'' (상수시 그림 갤러리, 포츠담)가 프러시안 블루가 사용된 가장 오래된 그림으로 알려져 있다. 1710년경, 프로이센 궁정의 화가들은 이미 이 안료를 사용하고 있었다. 거의 같은 시기에 프러시안 블루는 앙투안 바토와 이후 그의 후계자 니콜라 랑크레, 장바티스트 파테르가 그림에 사용한 파리에 도착했다.[4][10]
1724년에 영국의 존 우드워드가 이 안료가 초목의 재와 소의 혈액으로 제조할 수 있다는 것을 발표하면서, 제조 방법이 널리 알려지게 되었다.[72]
2. 2. 유럽으로의 확산
프러시안 블루는 이집트 파랑의 합성에 대한 지식이 사라진 이후 널리 사용된 최초의 안정적이고 비교적 내광성이 있는 파란색 안료였다. 유럽 화가들은 이전에 인디고 염료, 스몰트, 타이어 자색, 그리고 매우 비싼 울트라마린과 같은 여러 안료를 사용했다. 일본 화가와 목판화 예술가들 또한 유럽에서 프러시안 블루를 수입하기 전까지 오래 지속되는 파란색 안료를 사용할 수 없었다.[3]이 안료는 비싼 라피스 라줄리에서 추출한 울트라마린을 쉽게 대체했으며, 1708년과 1716년 사이에 요한 레온하르트 프리쉬와 프로이센 과학 아카데미 회장 고트프리트 빌헬름 라이프니츠 사이에서 오간 편지에서 중요한 주제였다.[7] 늦어도 1708년까지 프리쉬는 유럽 전역에서 이 안료를 홍보하고 판매하기 시작했다.
현재까지, 피터 판 데어 베르프의 1709년 작품인 ''그리스도의 매장'' (상수시 그림 갤러리, 포츠담)가 프러시안 블루가 사용된 가장 오래된 그림으로 알려져 있다. 1710년경, 프로이센 궁정의 화가들은 이미 이 안료를 사용하고 있었다. 거의 같은 시기에 프러시안 블루는 앙투안 바토와 이후 그의 후계자 니콜라 랑크레, 장바티스트 파테르가 그림에 사용한 파리에 도착했다.[4][10] 프랑수아 부셰는 파란색과 녹색 모두에 이 안료를 광범위하게 사용했다.[11]
2. 3. 아시아로의 확산
히라가 겐나이는 1763년 자신의 저서 『물류품식』에서 프러시안 블루를 소개했다. 이토 자쿠추가 1765년부터 1766년경에 걸쳐 제작한 『동식채회』의 「군어도(도미)」에서 루리하타를 묘사할 때 프러시안 블루를 사용한 것이 최초로 확인된 사례이다. 이후 1826년경부터 청나라 상인들이 영국에서 수입한 잉여분을 일본에 대량으로 수출하고 전매하면서 프러시안 블루가 널리 퍼지게 되었다.[73]1831년 가쓰시카 호쿠사이가 『후가쿠 36경』에서 곤청(프러시안 블루)을 사용하여 그린 짙은 청색이 호평을 받으면서 전국적으로 유행했다는 속설이 있다. 그러나 실제로는 덴포 개혁 당시 사치 금지령으로 인해 니시키에(錦繪, 비단 그림)의 색상이 제한되었고, 대량 수입으로 곤청의 가격이 하락하면서 유행하게 된 것이다. 우타가와 히로시게 등 당시 많은 화가들이 곤청을 사용했으며, 호쿠사이 역시 그중 한 명이었다. 호쿠사이에 앞서 일본에서 최초로 베로 남색(프러시안 블루)을 사용한 아이즈리에(藍摺絵, 남색 그림)를 그린 것은 호쿠사이의 제자인 게이사이 에이센이다.
3. 화학적 성질
프러시안 블루는 시안화물 염으로부터 제조되었음에도 불구하고, 시안화물기가 철에 단단히 결합되어 있기 때문에 독성이 없다.[23] 페로시안화물()과 페리시안화물()은 시안화물 이온에 대한 강한 철 배위로 인해 특히 안정하고 무독성인 중합체 시아노메탈레이트이다. 시안화물은 일반적으로 크롬과 같은 전이 금속과 잘 결합하지만, 이러한 비철 배위 화합물은 철 시안화물만큼 안정하지 않으므로 CN− 이온이 방출될 위험이 증가하고, 결과적으로 비교적 독성이 발생한다.[24]
프러시안 블루는 미세결정의 푸른색 분말이다. 불용성이지만, 결정체는 콜로이드를 형성하는 경향이 있다. 이러한 콜로이드는 미세한 필터를 통과할 수 있다.[29]
제일철 페로시안화물 염의 산화에 의해 생성된다. 이 백색 고체는 의 화학식을 가지며, 여기서 = 또는 이다. 이 물질의 철은 모두 제2철이며, 따라서 혼합 원자가와 관련된 짙은 색이 나타나지 않는다. 과산화수소 또는 차아염소산 나트륨으로 이 백색 고체를 산화시키면 페리시안화물이 생성되어 프러시안 블루가 얻어진다.[46]
"가용성" 형태인 는 실제로는 콜로이드이며, 페로시안화 칼륨과 철(III)으로부터 만들 수 있다.
:
페리시안화 칼륨과 철(II)의 유사한 반응은 동일한 콜로이드 용액을 생성하는데, 그 이유는 가 페로시안화물로 변환되기 때문이다.
"불용성" 프러시안 블루는 위의 반응에서 과량의 Fe(III)를 첨가하면 얻어진다.
: [22]
3. 1. 화학 조성 및 구조
프러시안 블루는 짙은 청색을 띠는 착화합물로, 헥사시아노철(II)산철(III), 페로시안화철(III), 페로시안화제2철, 곤청 등으로도 불린다.[74] 이상적인 화학 조성은 이지만, 실제로는 결정수를 포함하거나 일부 철 이온이 치환되어 조성이 일정하지 않은 경우가 많다.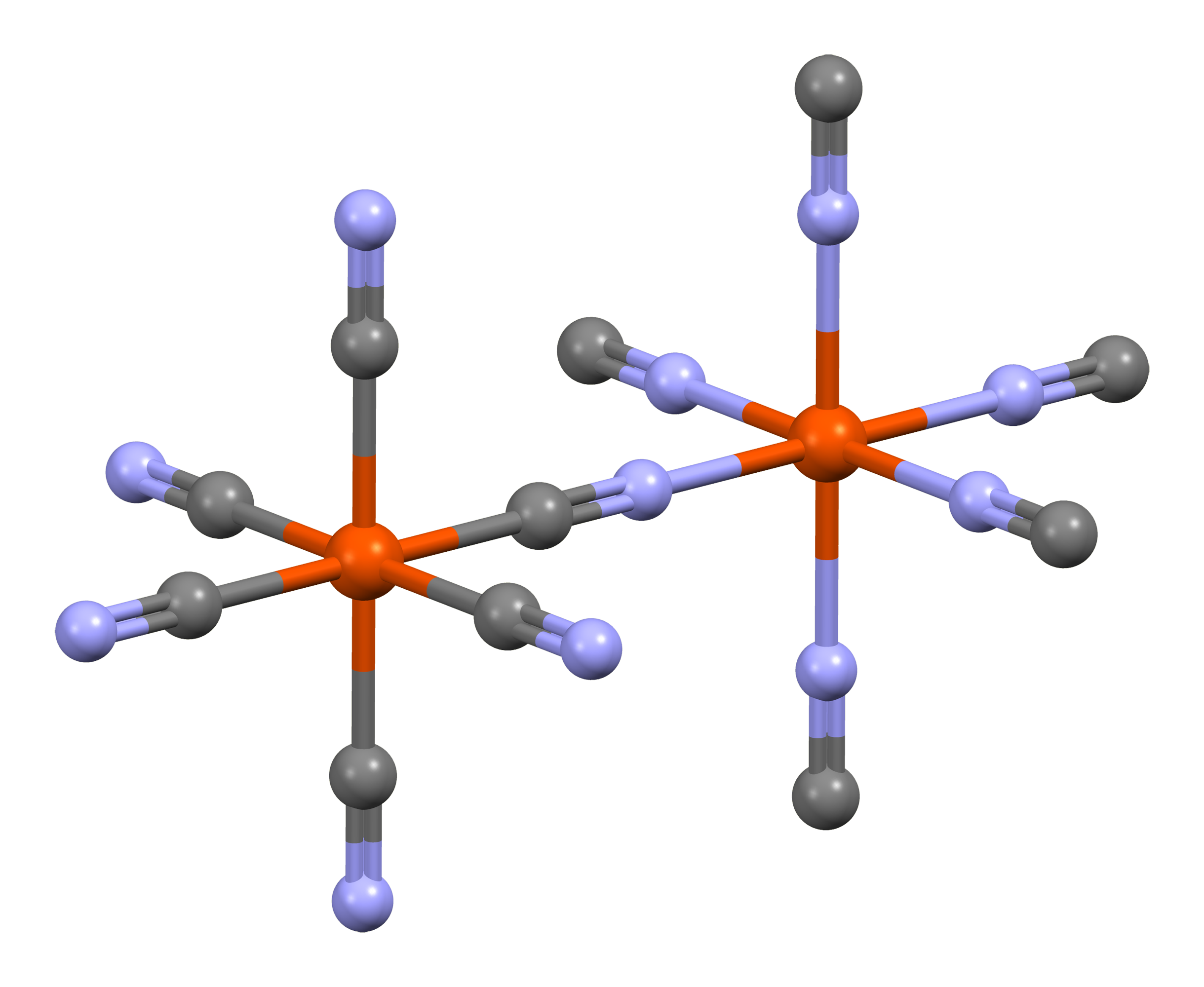

결정 구조는 이온이 면심 입방 격자를 형성하고, 각 변의 중간점에 이온이 위치한다. 이온은 질소 원자로 이온에, 탄소 원자로 에 배위한다. 이러한 구조를 갖는 시안 착염을 프러시안 블루형 착체라고 하며, 이들 중에는 강자성이나 페리자성을 나타내는 것이 많다.
좀 더 구체적으로 살펴보면, 이상적인 불용성 프러시안 블루 결정에서 입방형 구조는 Fe(II)–C–N–Fe(III) 시퀀스로 구성되며, Fe(II)–탄소 거리는 1.92 Å이고 Fe(III)–질소 거리는 2.03 Å이다. 서브유닛의 1/4은 비어 있기도 하다.[42]
저스핀인 Fe(II) 중심은 6개의 탄소 리간드로 둘러싸여 팔면체 구조를 갖는다. 고스핀인 Fe(III) 중심은 평균 4.5개의 질소 원자와 1.5개의 산소 원자(배위된 물 분자에서 유래)로 둘러싸여 역시 팔면체 구조를 갖는다.
3. 2. 색
프러시안 블루는 색이 매우 짙어, 유화 물감에 섞으면 검은색과 짙은 파란색을 띤다. 정확한 색상은 제조 방법에 따라 달라지며, 입자 크기를 결정한다. 프러시안 블루의 강렬한 파란색은 Fe(II)에서 Fe(III)로의 전자 이동 에너지와 관련이 있다.[29] 혼합 원자가 화합물은 혼합 원자가 전하 이동으로 인해 특정 가시광선 파장을 흡수한다. 이 경우, 약 680 나노미터 파장의 오렌지-빨간색 빛이 흡수되고, 반사된 빛은 결과적으로 파란색으로 보인다.[29]대부분의 고채도 안료와 마찬가지로, 프러시안 블루는 컴퓨터 디스플레이에 정확하게 표시될 수 없다. 프러시안 블루는 전색성을 띠며, 산화 환원에 의해 파란색에서 무색으로 변한다. 이러한 변화는 Fe(III)가 Fe(II)로 환원되어 프러시안 블루의 색상을 유발하는 혼합 원자가 전하 이동을 제거함으로써 발생한다.[29]
4. 물리적 성질
프러시안 블루는 미세결정의 푸른색 분말이다. 물에 녹지 않는 불용성이지만, 결정체는 콜로이드를 형성하는 경향이 있다.[29] 이러한 콜로이드는 미세한 필터를 통과할 수 있다.[29] 가장 오래된 인공 화합물 중 하나임에도 불구하고, 프러시안 블루의 조성은 수년 동안 불확실하게 남아 있었는데, 그 이유는 다음과 같다.
- 프러시안 블루는 극도로 불용성이지만 콜로이드를 형성하는 경향이 있다.
- 전통적인 합성법은 불순물이 섞인 조성을 생성하는 경향이 있다.
- 순수한 프러시안 블루조차도 구조가 복잡하여 일반적인 결정학적 분석을 어렵게 한다.
5. 합성
프러시안 블루는 1706년경 베를린의 화가 요한 야콥 디스바흐가 처음 합성한 것으로 추정된다.[4][5] 디스바흐는 붉은 코치닐 염료를 만들기 위해 잿물에 혈액이 섞인 것을 사용했는데, 이때 우연히 프러시안 블루가 만들어진 것으로 보인다. 원래 염료는 잿물, 염화철, 건조된 코치닐이 필요했지만, 혈액, 잿물, 황산철이 반응하여 페로시안화철이라는 화합물이 만들어지면서 뚜렷한 파란색을 띠게 되었다.[6] 1709년에 이 안료는 Preußisch blaude와 Berlinisch Blaude라고 명명되었다.[7][8][9]
1731년, 게오르크 에른스트 슈탈은 프러시안 블루 합성에 대한 최초 보고서를 발표했다.[12] 이 보고서에는 디스바흐뿐만 아니라 요한 콘라드 디펠도 관련되어 있다. 디스바흐는 코치닐에서 붉은 레이크 안료를 만들려 했지만, 오염된 잿물을 사용하면서 파란색을 얻게 되었다. 그는 디펠이 동물성 오일을 만드는 데 사용했던 잿물을 빌렸다. 1724년, 이 제조법은 존 우드워드에 의해 출판되었다.[13][14][15]
1752년, 프랑스 화학자 피에르 J. 마케는 프러시안 블루를 철의 염과 새로운 산으로 환원시킬 수 있으며, 이 산을 사용하여 염료를 재구성할 수 있음을 보였다.[16]
5. 1. 전통적인 합성법
프러시안 블루는 제일철 페로시안화물 염의 산화를 통해 생성된다. 이 백색 고체는 MFe[Fe(CN)]의 화학식을 가지며, 여기서 M = Na 또는 K이다. 이 물질의 철은 모두 제2철이며, 혼합 원자가와 관련된 짙은 색이 나타나지 않는다. 과산화수소 또는 차아염소산 나트륨으로 이 백색 고체를 산화시키면 페리시안화물이 생성되어 프러시안 블루가 얻어진다.[46]5. 2. "가용성" 및 "불용성" 프러시안 블루
"가용성" 프러시안 블루는 콜로이드이며, 페로시안화 칼륨과 철(III) 이온의 반응으로 만들 수 있다. 반응식은 다음과 같다.: K(+)|K(+)영어 + Fe(3+)| + Fe(3+)영어 + [Fe(2+)(CN)6](4-)| + [Fe(2+)(CN)6](4-)영어 → KFe(3+)[Fe(2+)(CN)6]|KFe(3+)[Fe(2+)(CN)6]영어
페리시안화 칼륨과 철(II) 이온의 유사한 반응도 동일한 콜로이드 용액을 생성하는데, 이는 [Fe(3+)(CN)6](3-)|[Fe(3+)(CN)6](3-)영어가 페로시안화물로 변환되기 때문이다.
"불용성" 프러시안 블루는 위 반응에서 과량의 Fe(3+)|Fe(3+)영어를 첨가하면 얻어진다.[22] 반응식은 다음과 같다.
: 4Fe(3+)|4Fe(3+)영어 + 3[Fe(2+)(CN)6](4-)| + 3[Fe(2+)(CN)6](4-)영어 → Fe(3+)[Fe(3+)Fe(2+)(CN)6]3|Fe(3+)[Fe(3+)Fe(2+)(CN)6]3영어
시안화물 염으로부터 제조되었음에도 불구하고, 프러시안 블루는 시안화물기가 철에 단단히 결합되어 있기 때문에 독성이 없다.[23]
5. 3. 턴불 블루
과거에는 철(II)염을 페리시안화물 용액에 첨가하면 프러시안 블루와 다른 물질을 얻을 수 있다고 생각했다. 이 생성물은 전통적으로 턴불 블루(Turnbull's blue)라고 불렸다. 하지만 X선 회절 및 전자 회절 방법을 통해 턴불 블루와 프러시안 블루의 구조가 동일하다는 것이 밝혀졌다.[25][26] 턴불 블루와 프러시안 블루의 색상 차이는 침전 방법의 미묘한 차이를 반영하며, 이는 입자 크기와 불순물 함량에 강하게 영향을 미친다.
5. 4. 프러시안 화이트
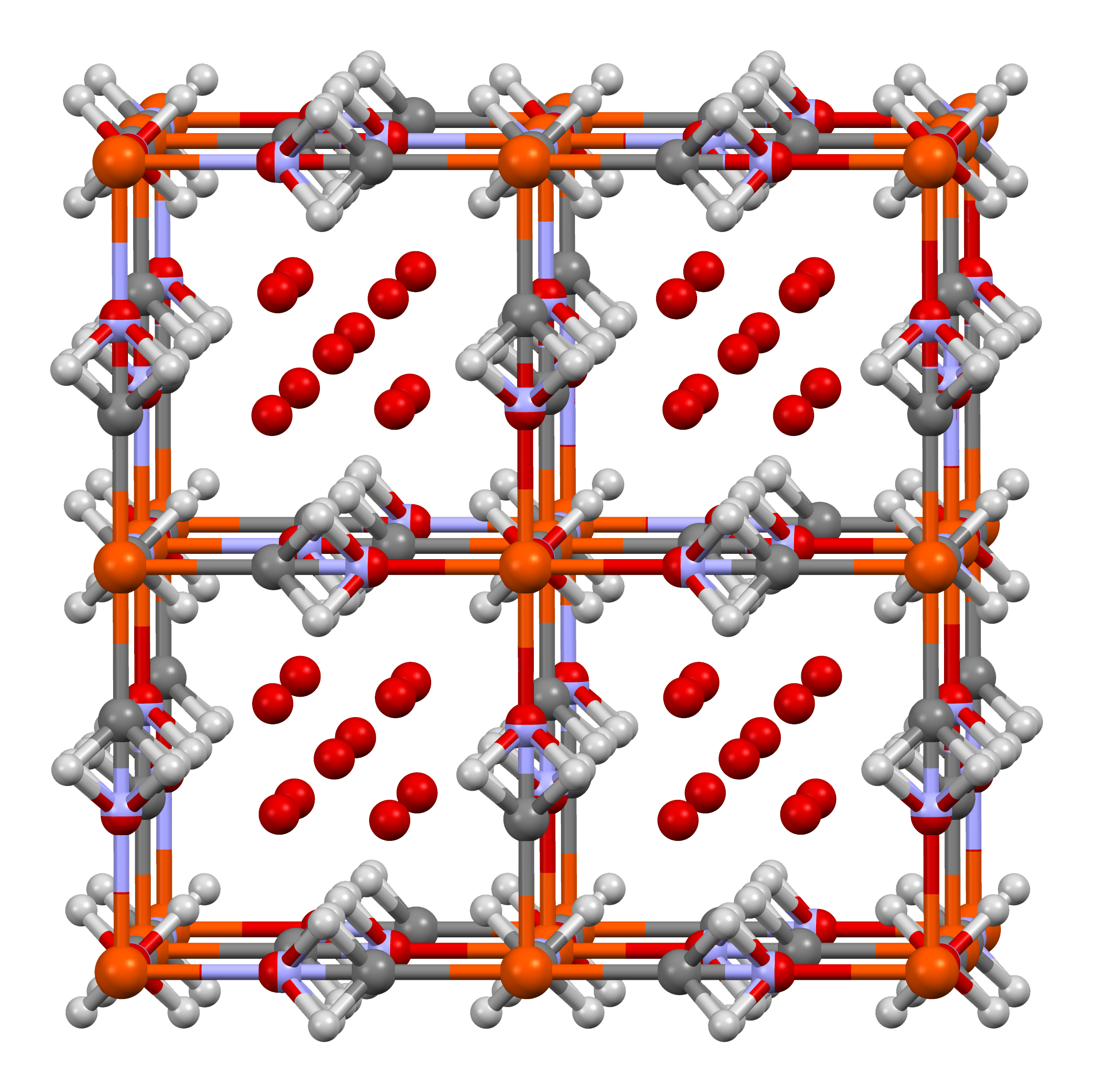
프러시안 화이트는 '베를린 화이트' 또는 '에버렛 염'이라고도 불리며, 프러시안 블루가 완전히 환원된 형태이다. 모든 철이 Fe(II)로 존재하며, 의 화학식을 갖는 Fe(II)의 나트륨 헥사시아노철산염이다.[27] 분자량은 314 g/mol이다.[27]일반적인 화학식은 (A 또는 B = 또는 )로, 양이온이 양이온으로 치환될 수 있다.
프러시안 화이트는 프러시안 블루와 유사하지만 결정 구조, 분자 프레임워크 기공 크기, 색상에서 차이가 있다. 입방형 나트륨 프러시안 화이트() 및 칼륨 프러시안 화이트()는 Na-이온 배터리의 음극 재료 후보 물질이다.[28] 칼륨 프러시안 화이트의 프레임워크에 및 양이온을 삽입하면 장기적인 배터리 안정성이 개선되고 재충전 사이클 횟수를 늘리는 효과가 있어 수명이 연장된다.[28] 프러시안 화이트의 큰 프레임워크는 및 양이온을 쉽게 수용하여 충전/방전 사이클 동안 삽입 및 추출을 용이하게 한다. 넓고 견고한 호스트 결정 구조는 여러 사이클 후 나트륨 배터리에서 발생하는 내부 팽윤 응력 및 변형에 대한 부피 안정성에 기여한다.[27] 또한 이 재료는 저온에서도 높은 재충전 속도를 제공하면서 높은 에너지 밀도(Ah/kg)를 제공하는 가능성을 보인다.[27]
6. 용도
프러시안 블루는 안료로서 남색이나 감색의 도료, 청사진, 인쇄 잉크, 물감 등에 사용된다.[45]
황연(크롬 옐로우), 카드뮴 옐로우, 아조계 노란색 안료와 혼합하여 녹색 안료로 사용되기도 한다. 크롬 옐로우, 카드뮴 옐로우와 함께 침전시켜 제조한 안료는 각각 크롬 그린, 카드뮴 그린이라고 불린다.
의학적 용도로는 특정 중금속에 대한 격리제로 유용하게 사용되는데, 특히 의약품 등급의 프러시안 블루는 탈륨이나 방사성 세슘을 섭취한 사람들에게 사용된다.[47] 국제 원자력 기구(IAEA)에 따르면, 성인 남성은 심각한 해를 입지 않고 하루에 최소 10g의 프러시안 블루를 섭취할 수 있다. 미국 식품의약국(FDA)은 "승인된 신약 신청 조건 하에 제조된 500mg 프러시안 블루 캡슐은 특정 중독 사례에서 안전하고 효과적인 치료법으로 확인될 수 있다"고 결정했다.[47][48]
조직병리학에서는 철 성분 검출을 위해 펄스 프러시안 블루 염색(Perls' Prussian blue stain)을 사용한다. 이 염색법은 독일 병리학자 막스 펄스가 1867년에 개발했다. --
엔지니어 블루는 유성 베이스의 프러시안 블루로, 평면도나 저널 베어링과 같은 금속 표면의 핸드 스크레이퍼 작업을 위한 전통적인 재료이다.[46]
분석화학에서는 총 페놀 분석에 사용된다. 700 nm에서 시료의 흡광도를 표준 물질과 비교하여 총 페놀 또는 폴리페놀을 정량할 수 있다.[52][53]
프러시안 블루(PB)는 1978년부터 전기화학적 에너지 저장 분야에서 연구되었다.[55]
6. 1. 안료
프러시안 블루는 1706년경 베를린의 화가 요한 야콥 디스바흐에 의해 처음 합성된 것으로 추정된다.[4][5] 디스바흐가 붉은 코치닐 염료를 만들기 위해 잿물에 혈액이 섞인 것을 사용했을 때 우연히 만들어진 것으로, 원래 염료에 필요한 잿물, 염화철, 건조된 코치닐 대신 혈액, 잿물, 황산철이 반응하여 페로시안화철이라는 화합물을 생성했다.[6] 1709년에 이 안료를 처음 거래한 사람이 Preußisch blaude(Preußisch blau|프로이시슈 블라우de)와 Berlinisch Blaude(Berlinisch Blau|베를리니슈 블라우de)라고 명명했다.[7][8][9]이 안료는 비싼 라피스 라줄리에서 추출한 울트라마린을 쉽게 대체했으며, 일본 화가와 목판화 예술가들은 유럽에서 프러시안 블루를 수입하기 전까지 오래 지속되는 파란색 안료를 사용할 수 없었다.[3]
프러시안 블루는 미세결정의 푸른색 분말이며, 불용성이지만 결정체는 콜로이드를 형성하는 경향이 있다.[29] 쉽게 만들 수 있고, 저렴하며, 무독성이면서 강렬한 색상을 띠기 때문에 발명된 직후 안료로 채택되어 유화, 수채화, 염색에 널리 사용되었다.[45]
일본에서는 히라가 겐나이가 『물류품식』(1763년)에 소개했고, 이토 자쿠추가 『동식채회』의 「군어도(도미)」(1765년부터 1766년경)의 루리하타를 그리는 데 사용한 것이 확인된 최초의 사용 예이다. 1826년경부터 청나라 상인이 영국에서 수입한 잉여분을 일본으로 대량 수출·전매하면서 급속히 퍼졌다. 가쓰시카 호쿠사이가 1831년에 그린 「후가쿠 36경」에서 곤청을 사용하여 그린 짙은 청색이 평판이 되어 이후 전국으로 퍼졌다는 속설이 존재하지만, 실제로는 덴포 개혁의 사치 금지령에 의해 錦繪(니시키에, 비단 그림)의 색이 제한된 점과 대량 수입에 의한 가격 하락을 계기로 유행하게 된 곤청 물감을 우타가와 히로시게 등 당시 다수의 화가가 사용했고, 호쿠사이도 또한 이를 이용한 사람 중 한 명에 지나지 않는 것이 실정으로 보인다.

200px의 『교토 명소 중 요도가와』. 분세이・덴포 이후의 우키요에에 특징적인 푸른색은 군청의 색이며, 재팬 블루 또는 히로시게 블루라고 불린다.]]
단독으로는 남색・감색의 도료, 청사진, 인쇄 잉크, 물감에 사용된다. 황연(크롬 옐로우), 카드뮴 옐로우, 아조계 노란색 안료와의 혼합물은 녹색 안료로 사용되며, 크롬 옐로우, 카드뮴 옐로우와 공침시키는 등 하여 제조한 것은 각각 크롬 그린, 카드뮴 그린이라고 불린다.
프러시안 블루는 세탁용 파랑의 일부 제제에 존재하며, 예를 들어 미세스 스튜어트의 세탁용 파랑이 있다.[54]
6. 2. 의학적 용도
프러시안 블루는 특정 중금속에 대한 격리제로 유용하게 사용되는데, 특히 의약품 등급의 프러시안 블루는 탈륨이나 방사성 세슘을 섭취한 사람들에게 사용된다.[47] 국제 원자력 기구(IAEA)에 따르면, 성인 남성은 심각한 해를 입지 않고 하루에 최소 10g의 프러시안 블루를 섭취할 수 있다.미국 식품의약국(FDA)은 "승인된 신약 신청 조건 하에 제조된 500mg 프러시안 블루 캡슐은 특정 중독 사례에서 안전하고 효과적인 치료법으로 확인될 수 있다"고 결정했다.[47][48] 라디오가르다제(불용성 프러시안 블루 캡슐[49])는 세슘-137의 장(소화관) 제거를 위한 상업적 제품으로, 간접적으로 세슘-137의 장간 순환에 개입하여 혈류에서 제거하고, 내부 체류 시간(및 노출)을 약 3분의 2로 줄인다.[50] 특히, 브라질의 고이아니아 사고에서 중독된 사람들로부터 세슘-137을 흡착하여 제거하는 데 사용되었다.[29]
라디오가르다제 캡슐(일본 메지피지스)은 일본에서 승인된 두 가지 적응증을 가진 의약품이다.
6. 3. 철 염색
조직병리학에서 철 성분 검출을 위해 펄스 프러시안 블루 염색(Perls' Prussian blue stain)을 사용한다. 이 염색법은 독일 병리학자 막스 펄스가 1867년에 개발했다. 펄스 프러시안 블루 염색은 페로시안화 칼륨과 산의 별도 용액을 사용하여 조직을 염색하는데, 현재는 염색 직전에 두 용액을 함께 사용한다. 조직 내에 철 침전물이 있으면 그 자리에서 자주색 프러시안 블루 염료를 형성하여 파란색 또는 자주색 침전물로 시각화된다.[51]6. 4. 기계공 및 공구 제작자
엔지니어 블루는 유성 베이스의 프러시안 블루로, 평면도나 저널 베어링과 같은 금속 표면의 핸드 스크레이퍼 작업을 위한 전통적인 재료이다.[46] 비건조성 페이스트 얇은 층을 기준 표면에 바르면 가공물의 높은 부분으로 전사된다. 그러면 공구 제작자는 표시된 높은 부분을 긁거나, 숫돌로 갈거나, 다른 방법으로 제거한다. 많은 분말 안료가 극도로 정밀한 기준 표면을 마모시킬 수 있기 때문에 프러시안 블루가 선호된다.[46] 다른 용도로는 기어 톱니의 조립 중에 인터페이스 특성을 결정하기 위해 표시하는 데 사용된다.6. 5. 분석화학
프러시안 블루는 총 페놀 분석에 사용된다. 시료와 페놀 표준 물질에 산성 염화 철(III)과 페리시안화물을 첨가하면, 페놀에 의해 페로시안화물로 환원된다. 염화 철(III)과 페로시안화물은 반응하여 프러시안 블루를 형성한다. 700 nm에서 시료의 흡광도를 표준 물질과 비교하여 총 페놀 또는 폴리페놀을 정량할 수 있다.[52][53]6. 6. 기타 용도
프러시안 블루는 남색, 감색의 도료, 청사진, 인쇄 잉크, 물감 등으로 사용된다.[45][46]황연(크롬 옐로우), 카드뮴 옐로우, 아조계 노란색 안료와 혼합하여 녹색 안료로 사용되기도 한다. 크롬 옐로우, 카드뮴 옐로우와 함께 침전시켜 제조한 안료는 각각 크롬 그린, 카드뮴 그린이라고 불린다.
골프장에서 겨울철 갈색으로 변색된 잔디에 착색하는 농약으로도 사용된다. 그러나 프러시안 블루의 1차 입자 크기는 0.1–0.05 마이크로미터로 매우 작아, 분진 형태로 흡입하면 폐에 침착되어 진폐증을 유발할 수 있다. 따라서 수지 등으로 굳혀 비즈 형태로 만들어 살포하기도 한다.
프러시안 블루(PB)는 1978년부터 전기화학적 에너지 저장 분야에서 연구되었다.[55] PB와 그 유사체(PBA)는 리튬 이온 배터리, 나트륨 이온 배터리, 칼륨 이온 배터리에서 알칼리 이온을 가역적으로 삽입 및 추출하는 전극 재료로도 평가받고 있다.
7. 안전성
프러시안 블루는 헥사시아노철(II)산염[78] 및 헥사시아노철(III)산염[79]과 같이 잘 분해되지 않는 시아노 착화합물이다. CN-영어 이온은 철 원자와 강하게 결합되어 유리되기 어렵기 때문에, 일반적인 생체에서 시안 화합물로서의 독성은 나타나지 않는다. 그러나 열이나 알칼리 조건에서는 약해져 시안 화합물이 유리될 수 있다. 국내법상 독극물 관리법 등에서는 시안 화합물의 예외로 취급되지만, 수도법 등 환경 관련 법규에서는 시험 조작에 의해 일부가 분해되어 전체 시안으로 간주되므로 규제를 받을 수 있다.
프러시안 블루의 1차 입자 크기는 0.1um–0.05um로 매우 작아, 공기 중에 날릴 경우 쉽게 폐에 도달하여 진폐증을 일으킬 수 있다. N95나 N100 등의 방진 마스크가 포착할 수 있는 입자 크기는 0.3um이므로, 이러한 방진 마스크로는 공기 중에 날리는 프러시안 블루 입자를 거의 막을 수 없다. 수지나 용제 등으로 입자를 굳혀도 환경에서의 풍화나 자외선 등에 의한 열화로 인해, 결국 이러한 미립자가 공기 중에 날릴 가능성이 있으므로 주의가 필요하다.
프러시안 블루는 열에 약하여 쉽게 분해되어 시안 가스를 발생시킨다. 이 때문에 가열하거나 സാധാരണ 소각하는 것은 위험하며, 프러시안 블루를 사용한 일부 착색제의 화학 물질 안전성 데이터 시트에는 화재 시 시안 가스가 발생할 가능성이 기재되어 있다.
7. 1. 일반적인 독성
프러시안 블루는 조성에 시아노 이온(CN-)을 포함하지만, 헥사시아노철(II)산염[78] 및 헥사시아노철(III)산염[79]과 같이 잘 분해되지 않는 시아노 착화합물이다. 시아노 이온은 철 원자와 강하게 결합되어 유리되기 어렵기 때문에, 일반적인 생체에서 시안 화합물로서의 독성은 나타나지 않는다. 그러나 열이나 알칼리 조건에서는 약해져 시안 화합물이 유리될 수 있다.7. 2. 환경 오염
프러시안 블루는 토양 오염 대책법상 특정 유해 물질로 규제될 수 있으며, 프러시안 블루로 인한 토양 및 지하수 오염이 문제가 될 수 있다.[78]지바현 모바라시의 도요잉크 관련 회사에서는 1962년부터 1975년까지 프러시안 블루를 생산했지만, 제조 당시 매립 처분되었던 프러시안 블루 폐기물에서 유리된 시안 화합물에 의한 토양 오염 및 지하수 오염이 확인되었다. 이후 오염된 토양은 굴착 및 교환되었고, 오염된 지하수도 양수 및 정화 작업을 거쳤으며, 지속적인 모니터링이 실시되었다.
쿠라레에서도 기기 유휴품 보관 장소에서 프러시안 블루가 부착된 기기 유휴품이 확인되었고, 토양 오염 우려로 인해 해당 장소의 토양이 굴착 및 처리되었다. 쿠라레의 2002년도 환경 활동 보고서에 따르면, 프러시안 블루는 물에는 안정적이지만 고알칼리에는 약하며, 환경에서 분해되어 시안 화합물(시안 착체)이 유리될 가능성이 있다고 한다.
7. 3. 방사성 세슘 관련 잠재적 위험성
프러시안 블루는 불용성 미세 입자로, 흡입하면 폐 깊숙이 도달하여 침착될 수 있다. 특히 방사성 세슘 137(프러시안 블루의 1차 입자 크기는 0.1–0.05 마이크로미터로 매우 작아, N95나 N100 마스크로도 완전히 막기 어렵다. 따라서 방사성 세슘이 존재하는 환경에서는 프러시안 블루 사용에 신중해야 한다.
8. 곤청의 탄생에 관한 작품
장-뤽 앙글베르(Jean-Luc Angéloubert)의 그림책 『파란색을 발견한 작은 얀』에서는 빨간색을 만들려다 백작 부인의 드레스 색깔을 표현하는 파란색이 만들어졌다는 이야기가 그려져 있으며, 프러시안 블루 발견의 역사적 사실을 주제로 하고 있다.[80]
참조
[1]
서적
International Tables for Crystallography, Vol. A
Wiley
2010-07-20
[2]
웹사이트
WHO Model List of Essential Medicines
http://apps.who.int/[...]
2013-10
[3]
서적
The Secret Lives of Colour
John Murray
[4]
논문
The early use of prussian blue in paintings
http://www.ndt.net/a[...]
[5]
문서
Kerrn aller Fridrichs=Städtschen Begebenheiten
Staatsbibliothek zu Berlin – Preußischer Kulturbesitz, Handschriftenabteilung
c.1730
[6]
서적
The Brilliant History of Color in Art
J. Paul Getty Museum
[7]
문서
Briefwechsel mit Gottfried Wilhelm Leibniz
Berlin, Stankiewicz Buchdruck, reprint Hildesheim/New York: Georg Olms Verlag, 1976
1896
[8]
논문
Serius Exhibita. Notitia Coerulei Berolinensis nuper inventi
https://babel.hathit[...]
1710
[9]
논문
"Notitia Coerulei Berolinensis nuper inventi" on the 300th anniversary of the first publication on Prussian blue
http://acshist.scs.i[...]
2011
[10]
논문
Early Prussian Blue. Blue and green pigments in the paintings by Watteau, Lancret and Pater in the collection of Frederick II of Prussia
https://philpapers.o[...]
[11]
논문
Prussian Blue, Boucher and Newton: the Material, Practice and Theory of Rococo painting
https://www.academia[...]
2001
[12]
서적
Georgii Ernesti Stahlii, Experimenta, Observationes, Animadversiones, CCC Numero, Chymicae Et Physicae: Qualium alibi vel nulla, vel rara, nusquam autem satis ampla, ad debitos nexus, & veros usus, deducta mentio, commemeratio, aut explicatio, invenitur. Qualium partim, in aliis Autoris scriptis, varia mentio facta habetur; partim autem nova commemoratio hoc Tractatu exhibetur: utrimque vero, universa res uberius explicatur atque confirmatur
https://books.google[...]
Haude
1731
[13]
논문
Praeparatio coerulei Prussiaci es Germanica missa ad Johannem Woodward..
[14]
논문
Observations and Experiments upon the Foregoing Preparation
https://zenodo.org/r[...]
[15]
웹사이트
The Creation of Color in Eighteenth-Century Europe: Prussian Blue
http://www.gutenberg[...]
2022-07-28
[16]
문서
"Éxamen chymique de bleu de Prusse," ''Mémoires de l'Académie royale des Sciences année 1752'' ... (Paris, 1756), pp. 60–77. This article was reviewed in "Sur le bleu de Prusse," ''Histoire de l'Académie royale des Sciences''... (1752), (Paris, 1756), pp. 79–85.
http://gallica.bnf.f[...]
1752
[17]
문서
"Försök, beträffande det färgande ämnet uti Berlinerblå" (Experiment concerning the coloring substance in Berlin blue), ''Kungliga Svenska Vetenskapsakademiens handlingar'' (Royal Swedish Academy of Science's Proceedings), '''3''': 264–275 (in Swedish). Reprinted in Latin as: "De materia tingente caerulei berolinensis" in: Carl Wilhelm Scheele with Ernst Benjamin Gottlieb Hebenstreit (ed.) and Gottfried Heinrich Schäfer (trans.), ''Opuscula Chemica et Physica'' (Leipzig ("Lipsiae"), (Germany): Johann Godfried Müller, 1789), vol. 2, pages 148–174.
https://books.google[...]
1782
[18]
문서
Tekhelet#Sepia officinalis
[19]
웹사이트
Has the long lost chilazon, source of the biblical blue techeiles dye been rediscovered?
http://www.chilazon.[...]
2008-04-08
[20]
서적
Frederick the Great's Army – Infantry
Bloomsbury USA
[21]
서적
World War One: German Army
Brassey's
[22]
문서
Inorganic chemistry
https://books.google[...]
Academic Press, 2001
[23]
논문
Suicide Attempt by Ingestion of Potassium Ferricyanide
https://www.tandfonl[...]
[24]
논문
Organic and Metal-Organic RFBs
https://doi.org/10.1[...]
2022-03
[25]
논문
Photoacoustic spectra of prussian blue and photochemical reaction of ferric ferricyanide
[26]
Submitted manuscript
Calorimetric study of Prussian blue and Turnbull's blue formation
https://digital.libr[...]
[27]
웹사이트
Prussian White
https://www.macsenla[...]
2023-10-28
[28]
논문
Higher voltage plateau cubic Prussian white for Na-ion batteries
Elsevier
[29]
서적
Chemistry of Transition Metal Cyanide Compounds: Modern Perspectives
[30]
논문
Electrochemistry of polynuclear transition-metal cyanides – Prussian blue and its analogs.
1986
[31]
논문
Low Defect FeFe(CN)6 Framework as Stable Host Material for High Performance Li-Ion Batteries.
2016
[32]
논문
Prussian blue analogues and their derived materials for electrochemical energy storage: Promises and Challenges.
2024
[33]
논문
Some performance characteristics of a Prussian blue battery.
1985
[34]
논문
A neutron diffraction study of Prussian blue, Fe4[Fe4(CN)6]3. 14D2O.
1974
[35]
논문
Valence Delocalization in Prussian Blue Fe(III)4[Fe(II)(CN)6]3·xD2O, by Polarized Neutron Diffraction.
1980
[36]
논문
Neutron Diffraction Study of Prussian Blue, Fe4[Fe(CN)6]3·xH2O. Location of Water Molecules and Long-Range Magnetic Order
Inorganic Chemistry
1980
[37]
논문
Neutron and X-ray diffraction studies on powders and single crystals of compounds structurally related to Prussian blue
Zeitschrift fur Naturforschung – Section B Journal of Chemical Sciences
1999
[38]
논문
Crystalline, mixed-valence manganese analogue of Prussian blue: Magnetic, spectroscopic, X-ray and neutron diffraction studies
Journal of the American Chemical Society
2004
[39]
논문
Neutron diffraction and neutron vibrational spectroscopy studies of hydrogen adsorption in the Prussian blue analogue Cu3[Co(CN)6]2
Chemistry of Materials
2006
[40]
논문
Neutron diffraction study of molecular magnetic compound Ni1.125Co0.375[Fe(CN)6]·6.4H2O
Physica B: Condensed Matter
2006
[41]
논문
Prussian blue analogues and their derived materials for electrochemical energy storage: Promises and Challenges
Materials Research Bulletin
2024
[42]
논문
Neutron diffraction study of Prussian blue, Fe4[Fe(CN)6]3·xH2O. Location of water molecules and long-range magnetic order
[43]
논문
Observations on the composition of Prussian blue films and their electrochemistry
[44]
웹사이트
Turning Big Ben's clock dials blue
https://www.parliame[...]
UK Parliament
2023-10-21
[45]
서적
Prussian Blue
National Gallery of Art
1997
[46]
간행물
Pigments, Inorganic
Wiley-VCH, Weinheim
2006
[47]
웹사이트
Questions and Answers on Prussian Blue
https://www.fda.gov/[...]
2020-03-20
[48]
웹사이트
Questions and Answers on Calcium-DTPA and Zinc-DTPA (Updated)
https://www.fda.gov/[...]
2018-11-03
[49]
웹사이트
Package insert with formula
http://www.heyltex.c[...]
2011-03-20
[50]
웹사이트
Heyltex Corporation – Toxicology
http://www.heyltex.c[...]
2007-11-12
[51]
웹사이트
Perl Formula for Perls Prussian blue stain
https://www.scribd.c[...]
2009-04-02
[52]
웹사이트
Tannin Chemistry
http://www.users.muo[...]
2011-03-18
[53]
논문
Stabilization of the Prussian blue color in the determination of polyphenols
1992
[54]
웹사이트
The Right Chemistry: Columbo, your laundry and liquid bluing
https://montrealgaze[...]
2016-01-22
[55]
논문
Electrochemical oxidation and reduction of thin films of Prussian blue
https://iopscience.i[...]
1978-06-01
[56]
논문
Some performance characteristics of a Prussian blue battery
1985-06-01
[57]
논문
Electrochemistry of polynuclear transition metal cyanides: Prussian blue and its analogues
1986-06-01
[58]
논문
Low defect FeFe(CN)6 framework as stable host material for high performance Li-ion batteries
2016-09-14
[59]
논문
Prussian blue analogues and their derived materials for electrochemical energy storage: Promises and challenges
Elsevier
[60]
서적
色の名前事典519
主婦の友社
[61]
문서
Color Index Generic Name
[62]
문서
Pigment Blue 27
[63]
문서
iron blue
[64]
문서
prussian blue
[65]
문서
berlin blue
[66]
문서
turnbull's blue
[67]
문서
milori blue
[68]
문서
chinese blue
[69]
문서
차이나블루とは別色
[70]
문서
paris blue
[71]
뉴스
プルシャン・ブルーの道(2)歓喜の表現あふれる画面は「青」で彩られてた
1990-06-09
[72]
서적
青の歴史
筑摩書房
[73]
문서
江戸期の日本ではドイツの首都名「ベロリン([[ベルリン]])」に因み、「ベロ[[藍色|藍]]」と呼ばれた。
[74]
PDF
プルシアンブルー;新しい応用とそのナノ粒子
https://www.kanto.co[...]
THE CHEMICAL TIMES
2013
[75]
PDF
プルシアンブルー使用に関する注意喚起
https://www.qst.go.j[...]
放射線医学総合研究所 緊急被ばく医療研究センター
[76]
웹사이트
ラディオガルダーゼ®カプセル500mg
https://www.nmp.co.j[...]
日本メジフィジックス
[77]
웹사이트
FACT SHEET Prussian Blue
http://www.bt.cdc.go[...]
CDC Radiation Emergencies
[78]
문서
ヘキサシアニド鉄(II)酸塩について、上記のヘキサシアニド鉄(II)酸カリウム({{chem2|K4[Fe(CN)6]}})はプルシアンブルー ({{chem2|KFe[Fe(CN)6]}}) とは別物である。
[79]
문서
ヘキサシアニド鉄(II)酸カリウムは非常に安定で水溶液中でシアン化物イオン ({{chem2|CN-}}) を放出せず毒性は低いが、ヘキサシアニド鉄(III)酸カリウム ({{chem2|K3[Fe(CN)6]}}) はやや不安定で、{{chem2|CN-}}を遊離するので有毒である。ここで言う有毒とは一定の条件下での主に水生生物を対象とする作用についてで、人体に対してではない。ヒトの肝臓は一時間あたり数十ミリグラムのシアンを無毒化する能力を持つため、シアノ錯体が分解して発生するシアンは少量であれば問題にならない(人が試薬を舐めても平気だが、排水中に経常的に含まれていると放流先の生態系がダメージを受ける、といった意味)。
[80]
서적
あおを はっけんした ちいさな ヤン - みならい えかきの おはなし
イマジネイション・プラス
2023-09-30
[81]
서적
Chemistry of Transition Metal Cyanide Compounds: Modern Perspectives
[82]
웹인용
WHO Model List of Essential Medicines
http://apps.who.int/[...]
2013-10
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

